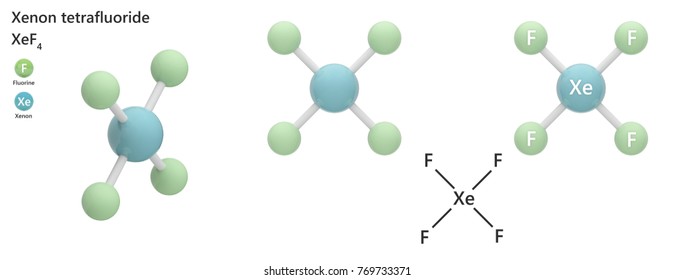
Le tétrafluorure de xénon est le composé chimique de formule XeF4. Il se présente sous forme d'un solide cristallin incolore qui se sublime à 115,7 °C. Il se forme à partir de xénon et de fluor dans les proportions molaires 1:2 en libérant une énergie de 251 kJ·mol-1 [,] :
- Xe 2 F2 → XeF4 251 kJ·mol-1
Il se décompose rapidement au contact de l'eau, même en présence de traces d'humidité dans l'air :
- 6 XeF4 12 H2O → 2 XeO3 4 Xe 3 O2 24 HF
Il doit donc être conservé à sec.
XeF4 réagit avec le fluorure de tétraméthylammonium N(CH3)4F pour former le pentafluoroxénate de tétraméthylammonium, de formule N(CH3)4XeF5 :
- XeF4 N(CH3)4F → N(CH3)4XeF5
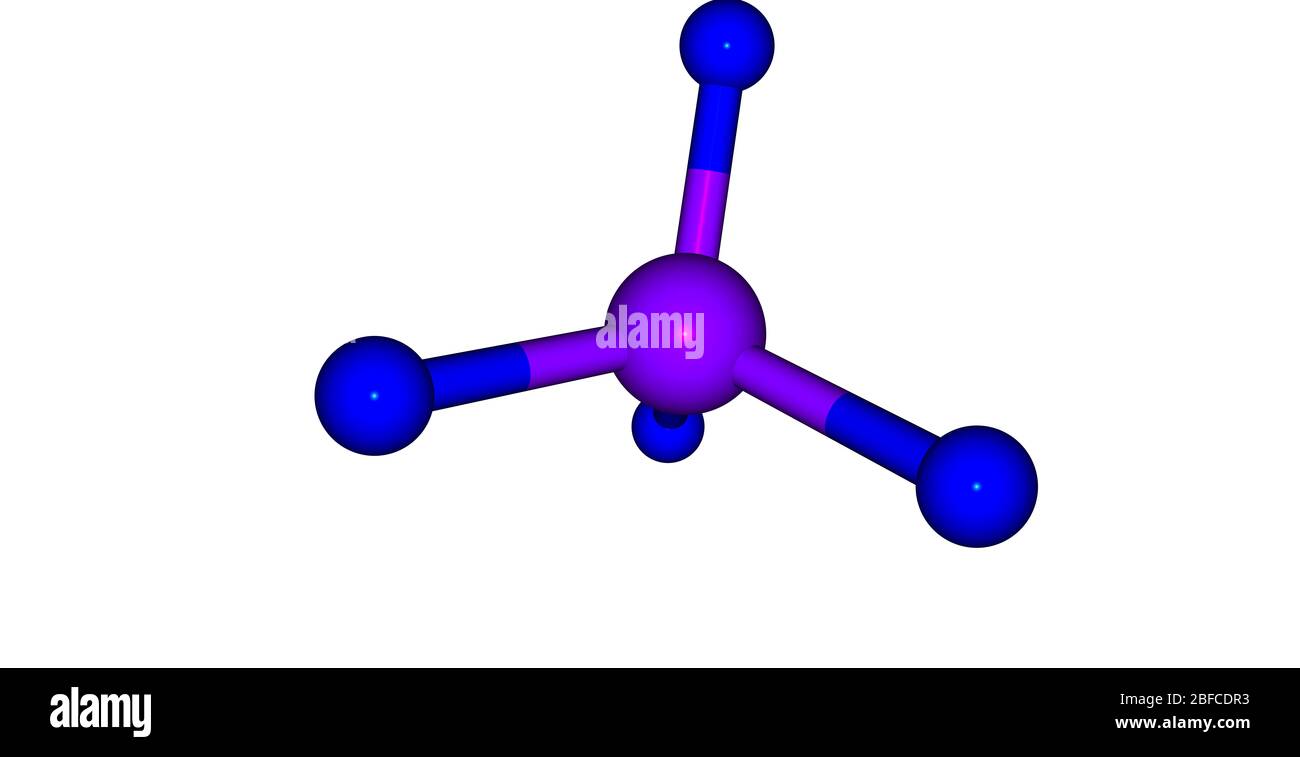
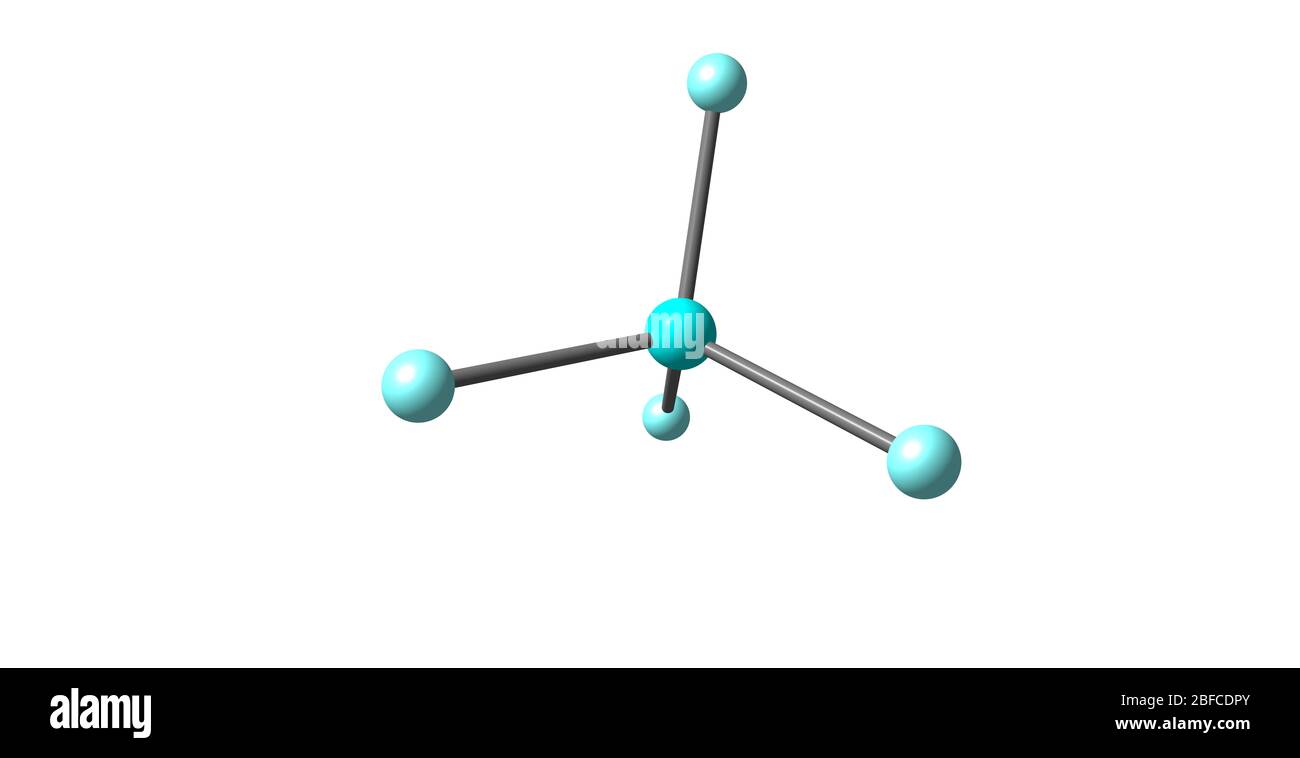
Le tétrafluorure de xénon est un solide cristallin incolore sous conditions normales. Sa structure cristalline fut déterminé par la spectroscopie RMN ainsi que la cristallographie aux rayons X en 1962,. La géométrie est plane carrée, ce qui a été confirmée par la diffraction de neutrons. Ceci s'explique par la théorie VSEPR parce que le xénon possède deux paires d'électrons non liants au-dessus et au-dessous du plan moléculaire.
Notes et références
Articles connexes
- Chimie des gaz nobles
- Molécule hypervalente
- Portail de la chimie